Dialogue intramoléculaire au sein du protéasome humain
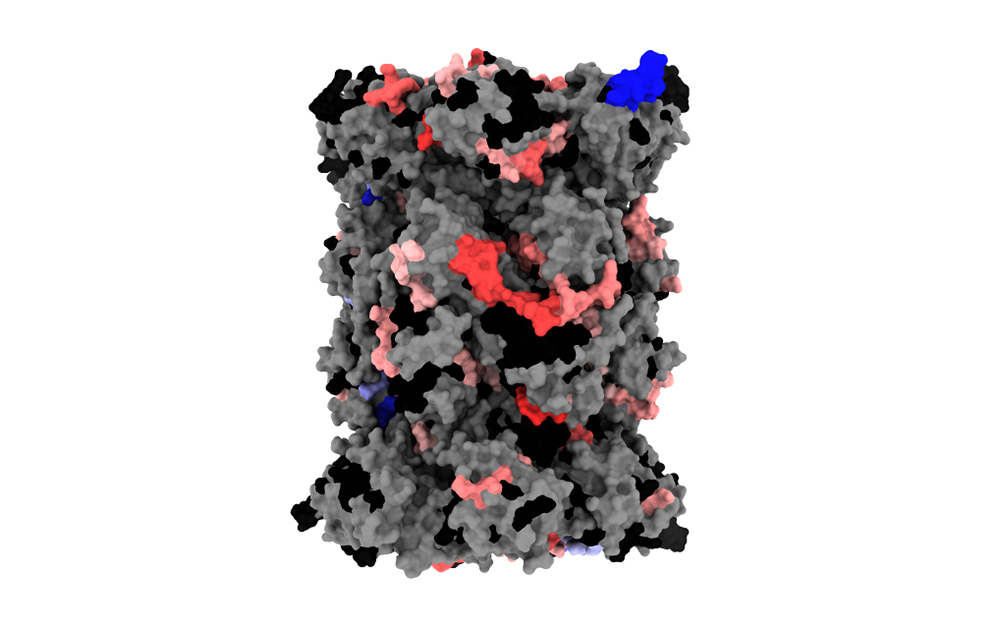
© Julien Marcoux & Jean Lesne
Le protéasome est une machinerie protéolytique permettant le recyclage des protéines intracellulaires. Sa dérégulation a été associée à différentes maladies neurodégénératives ainsi qu'à certains cancers. Ce travail, mené par une équipe européenne composée notamment de scientifiques de l'institut de pharmacologie et biologie structurale (IPBS - CNRS, Université Toulouse III - Paul Sabatier) et publié dans la revue Nature Communications, révèle un mécanisme de régulation enzymatique à distance entre les sites catalytiques enfouis dans le protéasome et sa surface accessible à ses activateurs. La méthode employée ouvre des perspectives sur l’étude de nombreux autres modulateurs de son activité et sur d’autres complexes multi-protéiques. (...)
Représentation de la structure 3D du protéasome humain standard (PDB : 5LE5)
Représentation de la structure 3D du protéasome humain standard (PDB : 5LE5)
© Julien Marcoux & Jean Lesne