Un complexe de protéines sucrées régule la migration cellulaire développementale et cancéreuse
La migration cellulaire orientée est un phénomène majeur de l’organogenèse qui repose sur des interactions multiples, finement contrôlées mais encore largement méconnues, entre récepteurs cellulaires et signaux environnementaux. Ces mécanismes sont souvent exploités ou contournés dans les pathologies cancéreuses. Dans une étude publiée dans Cell, des scientifiques internationaux, dont un chercheur toulousain de l'Institut de pharmacologie et biologie structurale1 , ont pu décrypter la contribution de deux protéines sucrées à la migration cellulaire. Cette découverte a été permise par des outils ciblant spécifiquement cette interaction dans deux contextes biologiques très différents, la migration des neurones au cours du développement cérébral et celle de cellules de neuroblastome, un cancer développemental du système nerveux périphérique.
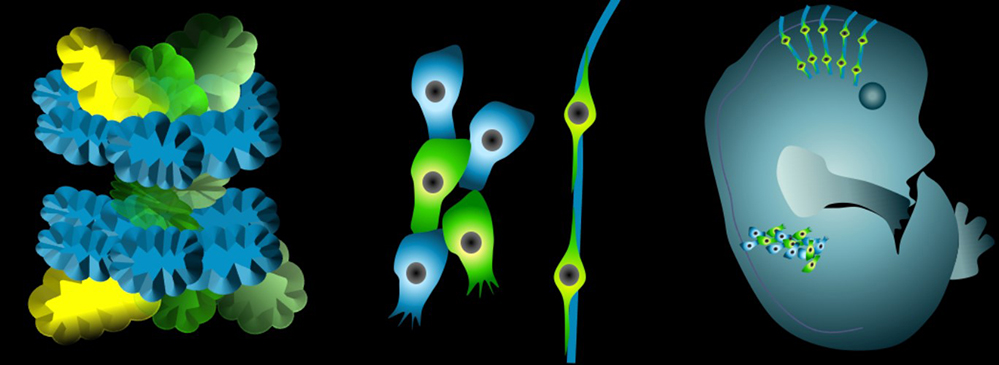
Panneau de gauche : à l’échelle moléculaire, structure octamérique du complexe UNC5-GPC3, avec 4 molécules UNC5 en alignement antiparallèle (représentées en jaune et vert) entourées par 4 molécules de GPC3 (représentées en bleu). Panneau du milieu : à l’échelle cellulaire, le complexe régule le mouvement de différents types cellulaires. Panneau de droite : à l’échelle de l’organisme, l’interaction contribue au développement du cerveau. Elle est également exploitée par un cancer dérivé de cellules embryonnaires qui forment le système nerveux périphérique.
© Valérie Castellani
Des scientifiques ont identifié comment deux protéines différentes, Unc5 et GPC3, agissent ensemble pour guider les mouvements des cellules. Une étude détaillée de la manière dont les protéines Unc5 et GPC3 s'associent à l'aide des sucres qu'elles portent à leur surface a été menée à l'aide d'une technique appelée cristallographie des protéines aux rayons X. Elle a été complétée par des simulations de dynamique moléculaire pour caractériser finement les acides aminés clefs des interfaces protéiques. Ces études ont révélé une organisation octamérique, dont le cœur du complexe formé de 4 molécules UNC5 en agencement antiparallèle est entouré par 4 molécules de GPC3. Ces analyses ont permis la production d'outils sophistiqués pour étudier la biologie de ces protéines.
- 1IPBS - CNRS, UT3